Reference
17 آوریل 2019
اتحاد هورمونها
لیام درو
نظام هورمونی مانند یک دموکراسی عمل میکند: هر بافت بدن ما یک اندام درونریز است که با آزاد کردن هورمون خواستهها و نیازهای خود را اعلام میکند.
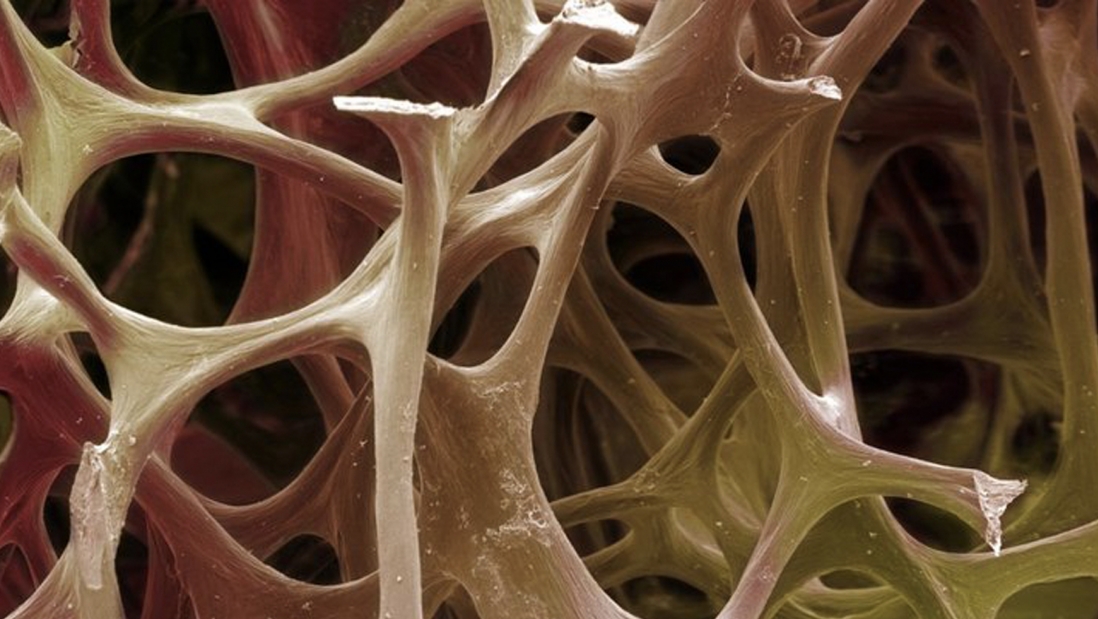
اندکی بیش از 20 سال پیش، جرارد کرسنتی، پزشک و متخصص ژنتیک، تصور میکرد که رمز و راز فرایند ذخیره کردن مواد معدنی استخوان را میداند، یعنی همان فرایند حیاتی که کلسیم، فسفر و مواد معدنی دیگر را به بافتی زایشی از پروتئینها پیوند میدهد تا استخوان را محکم کند. پروتئین کوچکی، به نام استئوکلسین، وجود دارد که سلولهای استخوانی آن را میسازند و آزاد میکنند، و کلسیم مشتاقانه به آن میچسبد. این ویژگیها کرسنتی را متقاعد کرده بود که استئوکلسین مادهای است که سلولهای استخوانی از آن طریق سختی استخوان را تنظیم و کنترل میکنند؛ و بنابراین او در آزمایشگاه دانشگاه کلمبیا در نیویورک شروع به اجرای طرحی کرد که ژن استئوکلسین را از موشها جدا میکرد. پیشبینی او این بود که، بدون استئوکلسین، استخوانهای موشها بسیار شکننده خواهد شد.
اما چنین اتفاقی نیفتاد. استخوانهای آنها کاملاً طبیعی بودند و از دست دادن استئوکلسین هیچ تأثیری بر فرایند استخوانسازی آنها نگذاشت. در واقع، استخوانهای این موشهای مهندسیشده سنگینتر از قبل بود. نتیجه چیزی شبیه به فاجعه بود.
سپس محقق فوق دکترایی که استخوانها را بررسی میکرد چیز عجیب و گیجکنندهای یافت: وقتی استئوکلسین غایب بود، برای رسیدن به اسکلت لازم بود که او بافت چربی بیشتری را بشکافد. این نتیجهی شگفتآوری بود که هیچکس انتظارش را نداشت. چگونه ور رفتن با استخوان موشها را چاق کرده است؟
کرسنتی تصور میکرد که ممکن است که آنها به خطا ژن اشتباهی را دستکاری کرده باشند. اگر آنها اتفاقاً ژنی را که برای متابولیسم چربی حیاتی و ضروری است برداشته باشند و استئوکلسین را دست نزده باشند، این امر میتواند توجیهی هم برای چربی و هم استخوانهای طبیعی باشد. اما نه، اشتباهی روی نداده بود.
فقط یک راه دیگر برای بررسی وجود داشت: استئوکلسین، که میدانیم در موشهای سالم، نه فقط در استخوان بلکه در خون نیز، وجود دارد، عاملی نبوده است که مسئول مواد معدنی استخوان بوده باشد. استئوکلسین از استخوان به سمت خون حرکت کرده و بعد به بافت چربی رسیده است، یعنی جایی که بر چگونی رفتار آن بافت تأثیر گذاشته است. چون استئوکلسین از طریق گردش خون از نقطهی آغاز (در این مورد، استخوان) به محلی دور (در اینجا، بافت چربی) حرکت کرده است تا عمل زیستیِ معناداری را انجام دهد، دانشمندان آن را هورمون مینامند.
مدتهاست که استخوان را چیزی بسیار بیشتر از چارچوب درونی ساکن و بیحرکت میدانند ــ به تدریج معلوم شده است که استخوان محل ساختن سلول قرمز خون، منبع پویای کلسیم بدن، و بافتی است که، منحصراً در بدن ما، دائماً و به نحوی فعال شکسته و دوباره از نو ساخته میشود. اما هنوز، این تصور که در عین حال، استخوان یک اندام درونریز است یعنی هورمون ترشح میکند ــ و در حفظ تناسب و تعادل پستانداران نقشی اساسی ایفا میکند، بعید به نظر میرسید. کرسنتی میگوید که «پذیرفتن آن برای ما 10 سال طول کشید. 10 سال طول کشید که من این را بپذیرم.»
کرسنتی و دیگران سرانجام تأیید کردند که استخوانها هورمونهایی را برای سلامت حیوان ترشح میکنند. و با این یافته، اسکلت به فهرست در حال افزایش بافتهایی اضافه شد که نشان میدهند در مکالمهای میان اندامها در سرتاسر بدن مشارکت دارند. مفهوم سنتیِ دستگاه درونریز به مثابهی دستگاهی که فرماندهی دوم است و با دستگاه عصبی همزمان کار و عمل میکند ــ و عمدتاً توسط مغز هدایت میشود ــ جای خود را به دیدگاه مستقلتر ارتباط میان اندامها میدهد، ارتباطی که در آن بیشتر اندامها، اگر نه همهی آنها، حق اظهار نظر دارند یا به عبارتی در آن شرکت دارند. درک و فهم منطقِ یک دستگاه کنترلکننده و نظارتگر که درآن اندامهای بدن هم هدف دستورات هورمونی باشند و هم منبع و منشأ آنها هنوز در مراحل ابتدایی به سر میبرد اما معانی ضمنیِ بالینی مهمی دارد.
هورمون به یونانی به معنای «تحریک کردن» یا «به راه انداختن» است.
از اواسط قرن نوزدهم به بعد، چند متخصص فیزیولوژی شروع به حدس و گمان دربارهی وجود پیامرسانهای شیمیاییای کردند که در داخل بدن فعالیت میکنند. از همه مشهورتر کلود برنارد، فیزیولوژیست فرانسوی، بود که هنگامی که نظراتش را دربارهی چگونگی فعالیت بدن برای حفظ دائمی یک محیط درونی باثبات ارائه میداد، گمان میکرد که «ترشحات داخلی» بخش اصلی این تنظیم و کنترل هستند. با گذشت زمان، این تصور که بافتهای معینی ــ از قبیل غدد آدرنال و تیروئید، به اضافهی غدد جنسی ــ نوعی پیامرسانهای بیواکتیو آزاد میکنند بیش از پیش مسلم شد، و این عمدتاً ناشی از مشاهدات بالینی بود.
نخستین هورمون در یونیورسیتی کالج لندن در بعدازظهر روز 16 ژانویهی 1902 کشف شد. ارنست استارلینگ و ویلیام بِیلیس، همکار و باجناق، مشغول آزمایش فرضیهای کمابیش مناقشهبرانگیز بودند. ایوان پاولف، فیزیولوژیست بزرگ روسی ــ همو که آزمایش به صدا درآوردن زنگ و ترشح بزاق سگهایش معروف است ــ ادعا کرده بود که دستگاه عصبی آزاد شدن شیرههای گوارشی قلیایی از لوزالمعده را کنترل میکند. اما استارلینگ و بیلیس در این مورد شک داشتند، و در عوض حدس میزدند که خود رودهی کوچک، اندامی که شیرههای گوارشی در آن جاری میشود، لوزالمعده را تحریک میکند. فرضیهی آنها این بود که محتویات اسیدی معده که به روده سرازیر میشود موجب آزاد شدن پیامی میشود که در خون جریان مییابد و پس از اینکه به لوزالمعده رسید آن را به صورتی کاملاً مستقل از دستگاه عصبی به فعالیت وامیدارد.
برای سنجش این فرضیه، استارلینگ و بیلیس سگی را بیهوش کردند، و اعصاب ناحیهای از رودهی کوچک حیوان را خارج کردند اما مویرگهای خونی را بر جای گذاشتند. سپس روده را از درون با اسید هیدروکلریک تحریک کردند، و منتظر شدند که ببینند آیا ترشحات لوزالمعده باز هم ایجاد میشود یا نه. هنگامی که شیرههای گوارشی بیرون آمد، استارلینگ اعلان کرد: «پس این باید نوعی واکنش یا پاسخ شیمیایی باشد.»
اما کار او تمام نشد. او بلافاصله بخشی از جدار روده را با شن و اسید بیشتر به کار واداشت، سپس این مخلوط را از صافی عبور داد و به رگ گردن سگ تزریق کرد. وقتی استارلینگ و بیلیس دیدند که لوزالمعده محتویاتش را حتی شدیدتر آزاد میکند، فهمیدند که پیامرسانی را جدا کردهاند که میتواند از طریق خون حرکت کرده و در نقاطی دور عمل کند. آنها این مادهی شیمیایی را سکرتین نامیدند.
آنچه کشف شد حلقهی بازخورد منفی بود ــ مفهومی بیش از پیش مهم در فیزیولوژی و شناخت غدد درونریز. مادهی اسیدیای که از معده میرسد سبب آزادی یک پیامرسان میشود. این پیامرسان سپس به لوزالمعده میرود و موجب آزادی شیرههای گوارشی قلیایی میشود تا محتویات روده را خنثی کند، و بدین طریق آزاد شدن پیامرسان پایان یابد. این یک نمونهی خاص سازوکار کنترل و نظارت عمومی است. هنگامی که یک دستگاه یا نظام زیستشناختی بر هم میخورد، یعنی میزان یک مادهی حیاتی کم و زیاد میشود، آن نظام طوری عمل میکند که از میزان آشفتگی کم کند. اگر قند خون بسیار بالا رود، در واکنش به آن از لوزالمعده هورمون انسولین آزاد میشود. انسولین به چندین بافت اطلاع میدهد که قند اضافه را جذب کنند، تا میزان قند خون کاهش یابد. اگر سردتان شود، به جای گرم میروید یا میلرزید، که هر دو به ترتیب روشهای رفتاری و فیزیولوژیکی برای کم کردن از میزان سرمای بدنتان است.
از قرار معلوم، در یک مهمانی شام در کیمبریج بود که یک پژوهشگر یونان باستان که بر حسب تصادف میشنود که استارلینگ دربارهی نوعی واکنش یا پاسخ شیمیایی با همکارش حرف میزند. او پیشنهاد میکند که این مواد شیمیایی متحرک را هورمون بنامند که به یونانی به معنای «تحریک کردن» یا «به راه انداختن» است.
پیدایش هورمونها رویدادی ابتدایی در تکامل حیوانات است.
استارلینگ اولین بار در سال 1905 این واژه را به طور علنی در یک سلسله سخنرانی با عنوان «همبستگی شیمیایی کارکردهای بدن» در رویال سوسایتی لندن به کار برد. در این سخنرانیها او به تکامل هورمونها پرداخت، و گفت به نظر میرسد که پیدایش هورمونها رویدادی ابتدایی در تکامل حیوانات است، و نخستین موجودات زندهی پرسلولی کاملاً بر پیامهای شیمیایی مبهم و پراکنده متکی بودند. او همچنین گفت وقتی دستگاههای عصبیِ در حال تکوین و تکامل حیوانات را به امکاناتی مجهز کردند که به طور الکتریکی به شرایط محیطیشان پاسخ دهند، این امکانات جای شبکهی ارتباطات شیمیایی را نگرفت.
استارلینگ «همبستگیهای شیمیایی»اش را به دو نوع تقسیم کرد. نوع نخست شامل واکنشهایی بود که بر اثر رویدادی خارجی ایجاد میشد، مانند فوران آدرنالین به هنگام بروز خطری در محیط که جریان خون را به سمت ماهیچهها هدایت میکند. نوع دوم واکنشهایی را در بر میگرفت که درون بدن ایجاد میشوند، صرفنظر از آنچه در خارج روی میدهد ــ مثل تعاملات حلقهایِ چهار هورمون اصلی که چرخهی تولیدمثل زنان را تنظیم میکنند.
سخنرانیهای استارلینگ، که فقط دو سال پس از کشف سکرتین صورت گرفت، به نحو چشمگیری پیشگویانه مینمود. او مطمئن بود که شبکهی عظیمی از پیامهای شیمیایی میان اندامهای بدن در رفت و آمدند تا فعالیتهای آنها را با یکدیگر هماهنگ کنند.
از آن زمان به بعد، تعداد هورمونهای شناختهشده افزایش یافت. اعمال زیستشناختیِ شیرههای غدههایی که معلوم شده بود کارکردهای درونریزی دارند شرح و توضیح داده شد، و تمام جزئیات مؤلفههای فعال آنها معلوم شد. در دهههای 1920 و 1930، هورمونهای جنسی استروژن، پروژسترون و تستوسترون به طور مجزا مورد بررسی قرار گرفتند و ویژگیهای آنها کشف شد. در دههی 1950، هورمونهایی که از مغز ــ از غدهی هیپوفیز و هیپتوتالاموس ــ آزاد میشوند توضیح داده شدند، و تعاملاتشان با دیگر غدههای هورمونساز بدن نشان داده شد. پس از آن، راههایی که هورمونها سلولهای هدف خود را در سطح مولکولی تحت تأثیر قرار میدهند کشف شد ــ بعضی لحظهای عمل میکنند، و بعضی با تغییر بیان ژن تأثیرات بلندمدت میگذارند.
مفهوم بافتهای هدف مهم بود. یکی اندامهای درونریز بودند ــ که بیشتر آنها بافتهای غدهمانندی بودند که کارکرد اصلیشان ساختن و تراوش کردن مواد است ــ و یکی اندامهایی بودند که هورمونها بر آنها عمل میکردند. کتابهای درسی تصاویری نشان میدادند، و اغلب هنوز هم نشان میدهند، که دستگاه غدد درونریز به مثابهی تعداد کمی از غدد به اضافهی غدد جنسی هستند: مجمعالجزایری از جزیرههای هورمونساز که اینجا و آنجا در بدن پراکندهاند.
اما رشد فهرست هورمونها و بافتهایی که آنها را تولید میکنند هیچوقت متوقف نشد. هورمونهای خاصی که مدتها تصور میشد جریان خون، جذب مواد در روده و تولید سلولهای خونی را تنظیم میکنند سرانجام معلوم شد که از کلیه میآیند. معلوم شد که کبد هورمونهایی را تولید و ترشح میکند. و سکرتین فقط یکی از چندین پیام در گردشی بود که از دستگاه گوارش نشئت میگیرد.
در دههی 1970، اهمیت تعامل دوسویه میان مغز و دستگاه ایمنی اثبات شد. سپس، در اوایل دههی 1990، وقتی دانشمندان دانشگاه راکفلر در نیویورک در صدد برآمدند که بفهمند چرا یک نژاد شناختهشده از موشهای آزمایشگاهی به طرزی بیمارگونه چاقاند، دریافتند که علتش آن است که آنها فاقد هورمونی هستند که لِپتین نامیده میشد، هورمونی که اشتها را به نحو مؤثری فرومینشاند، و توسط بافت سفید چربی تولید و آزاد میشود. لپتین میتواند موشها را به کم خوردن وادارد؛ بنابراین علاقهی شدیدی به استفاده از خواص زیستی آن پیدا کردند تا بتوانند داروهایی تولید کنند که همین کار را در آدمیان انجام دهد ــ هدفی که هنوز، به دلایل گوناگون، تحقق نیافته است.
اما هنگامی که جستجوی داروی زایلکنندهی اشتها در آغاز هزارهی سوم میلادی شدت گرفت و موفقیتهایی کسب کرد، کرسنتی به دنبال دیگر کارکردهای لپتین بود. او میدانست که این هورمون در عین حال تودهی استخوانی را هم تنظیم میکند ــ یعنی ذخیرهی انرژی و مصرف آن کاملاً به استخوان مربوط است. در همان حال، دیگر پژوهشگران فهمیدند که پوست یک اندام درونریز است، و فهم کاملتری از ملکولهای پیامدهندهی آزادشده توسط قلب به دست آوردند.
در مجموع، فهمیدهایم که بیشتر اندامها کارکرد درونریزی دارند. آنچه زمانی فقط بافتهای هدف شمرده میشد، اکنون معلوم شده که محرک ترشح هورمون هم هست. اگر ندانیم که اندامی هورمون مهمی را تراوش میکند، معقول به نظر میرسد که ببینیم آیا به قدر کافی آن را بررسی کردهایم یا نه. بیش از یک قرن پس از آن که استارلینگ سخنرانیهای معتبرش را ایراد میکرد، به نظر میرسد که زیستشناسی سرانجام به تحقق گسترهی کامل «دستگاه عظیم همبستگیها»ی او نزدیک شده است.
هیچ یک از اندامهای بدن ما یک جزیره نیست.
گسترهی بافتهایی که اکنون میدانیم هورمون آزاد میکنند مستلزم تجدیدنظر در مفهوم دستگاه غدد درونریز است. اگر فقط مجموعهی محدودی از بافتهای غدهای رفتار اندامهای گوناگون بدن را هدایت نمیکنند ــ دستگاه کنترلی که مکمل دستگاه عصبی باشد ــ پس پای چه چیزی در میان است؟ به نظر میرسد که چیز بسیار فراگیرتر و دموکراتیکتری باشد ــ دستگاهی که از آن طریق تمام اندامهای بدن وضعیت خود را با ترشح مولکولهایی به درون خون پخش و اعلان میکنند و به این ترتیب، با یکدیگر، فعالیت بدن در هر لحظهی مشخص را شکل میدهند.
این تصور با کشف مولکول متفاوتی که توسط استخوان ساخته و آزاد میشود و به سرعت به مثابهی یک هورمون شناخته شد تا حدی تأیید شد. این مولکول که نخست در سرطانی کشف شد که به تحلیل استخوان میانجامید، و افجیاف-23 (FGF-23) نامیده شد، مقدار فسفری را تأمین میکند که اسکلت لازم دارد، و ثابت میکند که استخوان هورمونی تولید کرده است. اما کرسنتی تصور نمیکرد که این امر ثابت کند که استخوان یک اندام درونریز مهم است. به گفتهی او، «افجیاف-23 کارکردی را تنظیم میکند که ارتباطی تنگاتنگ با سلامت استخوان دارد.» به نظر میرسید که این مولکول شبیه سکرتین است: هورمونی که در یک حلقهی مستقل عمل میکند و به یک اندام واحد امکان میدهد تا کارش را بهتر انجام دهد.
در سال 2007 بود که کرسنتی بیاساس بودن این تصور رایج را از طریق استئوکلسین نشان داد؛ برای توضیح این که چرا موشهای فاقد استئوکلسین چاق شدند، استخوان باید اندام درونریزی باشد که فقط نظم زیستی خودش را تنظیم نکند. پژوهشگران پیش از این نشان داده بودند که چربی از طریق تولید هورمونهایی که اشتها را کنترل میکند در طرز استفادهی بدن از منابع انرژی دخالت دارد. اکنون استخوان نیز به شبکهی فزایندهای از اندامهایی پیوسته که با یکدیگر کار و عمل میکنند تا تعادل دینامیک بدن (همایستایی یا هومئوستازی) را از نظر جریان انرژی (مصرف غذا) حفظ کنند.
گروه کرسنتی در مقالهای با عنوان «کنترل درونریز باروری مردان از طریق اسکلت» (2011) شبکهی تعاملات را بسط دادند. در این مقاله، آنها توضیح دادند که چگونه موشهای نر فاقد استئوکلسین به اندازهی موشهای نری که این هورمون را داشتند زادوولد نکردند، و نقش این مولکول را در تنظیم کردن تولید تستوسترون نیز نشان دادند.
این دو بررسی نشان داد که استخوان با اندامهایی که تصور میکنیم استخوان را کنترل میکنند سخن میگوید. هورمونهای تراوشیافته از بافت چربی و غدد جنسی بر استخوان تأثیر میگذارد، و ناگهان شواهدی پیدا شد مبنی بر این که صرفاً این اندامها استخوان را هدایت نمیکنند بلکه بافتها نیز درگیر گفتگو و مکالمه با هم میشوند. کرسنتی پیشبینی میکند که این یک اصل عمومی و کلی علم دستگاه غدد درونریز است «که راه میان دو اندام یکطرفه نیست».
اما این همهی ماجرا نیست. موشهای فاقد استئوکلسین دارای خصیصهی دیگری هم بودند که نیاز به بررسی و توضیح داشت ــ و آن رفتارشان بود. افرادی که در آزمایشگاه بودند در موارد گوناگون گزارش کرده بودند که موشها به نظر کودن یا به نحو بیمارگونهای ساکت و آرام به نظر میرسیدند. و حال زمان آن بود که این موضوع از نظر علمی بررسی شود.
از طریق آزمایشهای دقیق، فرانک اوری، پژوهشگر فوق دکترای کرسنتی و بقیهی اعضای تیم دریافتند که مغز گیرندهی منحصربهفردی برای استئوکلسین دارد؛ استئوکلسین، از طریق کارش در این گیرندهی عصبی، کارکرد مغز را تنظیم میکند. موشهایی که فاقد این هورمون هستند مهارتهای حافظهایِ ناچیزی دارند، در اضطراب محض به سر میبرند، و میزان انتقالدهندههای عصبی گوناگونشان بسیار متفاوت است.
تحقیقات اولیه چهارچوبی برای وابستگیهای متقابل میان بافتهای استخوانبندی، متابولیک و تولیدمثلی فراهم کرد. این طرح دارای معنایی شهودی است: منابع انرژی باید به طرزی مناسب توزیع شوند تا سلامتی استخوان حفظ شود و جفتگیری انجام گیرد. اما این واقعیت که استخوان کارکرد عصبی را تنظیم کرده است به این معناست که مغز نیز باید وارد گود شود. به گفتهی کرسنتی «باید سعی کنیم که این منطق تکاملی را بفهمیم که مولکول و اندامی داریم که حافظه، راهاندازی و تولیدمثل را کنترل میکند. و این آن چیزی است که اکنون بر روی آن کار میکنیم.»
شواهد در حال جمع شدن هستند. مقالهای که در نوامبر 2018 منتشر شد، نقش جامعتر هورمون استخوان، افجیاف-23، فراتر از تنظیم فسفر را بررسی میکند. مقالهی دیگری، که همان ماه چاپ شد، کارکردهای جدید نخستین هورمون کشفشده، سکرتین، را توضیح میدهد: سکرتین، علاوه بر تأثیراتش بر لوزالمعده، بافت چربی قهوهای را هم بعد از غذا خوردن تحریک میکند. بافت چربی قهوهای فعالشده گرما تولید میکند، دمای بدن را بالا میبرد و جلوی بیشتر غذا خوردن بیشتر را میگیرد.
مادر و جنین را میتوان شبکهای واحد از تعاملات هورمونی دانست، و نه دو شبکهی جداگانه که مجاور یکدیگرند.
نوربرت پریمون، متخصص ژنتیک در دانشکدهی پزشکی هاروارد، روی پشهی میوه یا پشهی سرکه (دروزوفیلا) تحقیق میکند. در گذشته، او انواعی از ابزار ژنتیکی را پرورش داده بود که این ارگانیسم را به موجود مناسبی برای مطالعهی زیستشناسی تبدیل میکند. اما اخیراً، او به این پرسش پرداخته است که چگونه بافتهای حیوان شرایط درونی گوناگون را حس میکنند، و چه پیامهایی را به خارج از مرزهای خود میفرستند. اگر اصطلاحی را که او با دانشجوی ارشدش ایلیا دروجینین در 2013 ابداع کرد به کار بریم، او اکنون به مطالعهی شبکهی ارتباطی میاناندامی (ICN) میپردازد. این واژهی اختصاری اکنون بیشتر از اصطلاح قدیمی، یعنی شناسایی دستگاه غدد درونریز یا اِندوکرینولوژی، چگونگی تحول و تکوین این رشته را توضیح میدهد. به گفتهی پریمون «به عقیدهی من، به مجرد آن که شما یک اندام را لمس میکنید، آن اندام واکنشی را در اندامهای دیگر موجب میشود.»
یکی از مطالعات آزمایشگاهی اولیه شامل عواملی به نام میوکین بود که توسط ماهیچهها برای تنظیم و تعدیل رشد و توزیع انرژی به کار میافتد. تیم پریمون علاقهی خاصی به میوکینها و فرایند پیری داشت. فابیو دمونتیس در آزمایشگاه با استفاده از یک راهکار ژنتیکی به طور گزینشی فرایند پیری ماهیچههای خاصی از پشهها را کند کرد. سپس کل بدن حشره را بررسی کرد تا بفهمد که آیا پیری در بافتهای دیگر هم کند شده است یا نه. بله کند شده بود ــ نتیجهای که با شگفتی حاکی از این است که کل فرایند پیری حیوان توسط عواملی تنظیم میشود که ماهیچهها آن را به درون همولنف پشهی سرکه ترشح میکنند. [بیمهرگان، از جمله حشرات، به جای خون مایعی پلاسمامانند به نام همولنف دارند.]
معنای ضمنی وسیعترش آن بود که ماهیچه در پشهها ــ و احتمالاً در پستانداران ــ شاید چون مدام در وضعیت انقباض و شل شدن است به سرعت تحلیل میروند. وقتی میوکینها، که توسط ماهیچههای سالم آزاد میشوند، کاهش یابند، کل بدن حیوان به ضعف و نابودی میگراید. از زمان انتشار این پژوهش در سال 2010، دمونتیس تحقیقش را بر اساس فهم دقیق این موضوع بنا نهاده است که کدام میوکینها در این فرایند دخالت دارند و آیا میتوان آنها را برای درمان ضعف ناشی از بالارفتن سن در آدمیان مهار کرد یا نه. در واقع، در سالهای اخیر عدهی زیادی به این عقیده روی آوردهاند که تغییر در عوامل در حال گردش در خون نقش مهمی در فرایند پیری دارد. این تصور عمدتاً ناشی از آزمایشهایی است که نشان میدهد خون موشهای جوان میتواند بافتهای متعددی را در موشهای پیرتر، از جمله مغز آنها را، از نو جوان کند. نتایجی که گروه کرسنتی به دست آوردهاند حاکی از آن است که پر کردن جاهای خالی در استئوکلسین میتواند نقشی کلیدی در این قضیه داشته باشد.
بررسی میوکین تا اندازهای نشاندهندهی تلاش اولیهی گروه هاروارد برای کشف عوامل هورمونیِ ناشی از یک بافت است که بر بافتهای دیگر تأثیر میگذارد. اما اکنون پریمون میخواهد کل شبکهی ارتباطی میاناندامی را به نحوی منظمتر تعریف کند. برای این کار، آزمایشگاه او طرح ساده اما روشن و دقیقی را به کار میگیرد. این طرح متضمن ورود ژنتیکیِ هر بار یک آنزیم به یک اندام است تا به تمام پروتئینهایی که این اندام ترشح میکند برچسب بزند. این برچسبِ همهجا به کاربردهشده به این علت انتخاب میشود که مولکول دیگری وجود دارد که مانند چسب به آن ــ و فقط به آن ــ میچسبد. محققان تمام اندامهای دیگر پشه را، یک به یک، دنبال میکنند تا فهرست تمام پروتئینهایی را که اندام الف آزاد میکند تا سرانجام به اندام ب برسد، تهیه کنند.
این طرحها تعداد نسبتاً زیادی پروتئین را در پشهی میوه شناسایی کرده است. این فهرست شامل دهها پروتئینِ پیش از این ناشناخته است. پریمون توجه خود را به پروتئینهایی معطوف میکند که میان پشهها و پستانداران مشترکاند.
به گفتهی او «من معتقدم که به زودی میتوانیم چیزهای کاملاً جدیدی را کشف کنیم»، هرچند «آنچه واقعاً زمانبر است ادامهی تجزیه و تحلیل برای ثابت کردن این است که این عوامل واقعاً کارهای جالبی انجام میدهند.»
هنگامی که هورمون جدیدی شناسایی میشود و معلوم میشود که کارکرد مهمی دارد، مسیری را روی یک نمودار برای خود فراهم میکند، مانند مسیری که پریمون و دروجینین در سال 2016 برای بازبینی جزئیات طرحهایشان در مورد توضیح شبکهی ارتباطی میاناندامی در پشههای میوه ساختند. آنها به کمک یافتههای اخیر در پستانداران، ماهیچهی اسکلت، لوزالمعده، مغز، استخوان، روده، بیضه، قلب، کلیه، بافت چربی و کبد را تقریباً به شکلی دایرهای مرتب کردند. و سپس، پیکانهایی رسم کردند تا پیوندهای هورمونی جدیداً شناساییشده را میان جفتهای بافتی نشان دهد. نتیجه ملغمهای شتابزده از پیوندها و اتصالات بود.
مفهوم کلاسیک حلقههای بازخوردی منفی ــ که هر یک متغیر فیزیولوژیکی خاصی را تنظیم و کنترل میکنند ــ مفهومی اساسی و مهم در زیستشناسی است. اما اکنون روشن شده که حلقههای بسیاری وجود دارند و این حلقهها همگی با هم ارتباط دارند.
پریمون اکنون مصمم است که از نمودارهای جدید چیزهای بیشتری بفهمد. او میگوید که «ما از چربی به روده، از روده به ماهیچه، از ماهیچهها به چربی، از ماهیچهها به روده در حال مشاهده و بررسی هستیم.» او مکث میکند، سپس با خنده میگوید: «و این بسیار گیجکننده است.»
پس چرا بیشتر بافتها، و احتمالاً همهی آنها، دارای عنصری درونریز در خودشان هستند؟ پریمون و دروجینین با نظر به اندیشههای اولیهی استارلینگ نوشتهاند که این پرسش چه بسا به اندازهی بازگشت به ظهور نخستین علایم حیاتی از پرسلولیها مهم و بنیادی باشد. هنگامیکه موجودات زنده پیچیدهتر شدند، و انواع متفاوتی از سلولها به وجود آمدند تا کارکردهای تخصصی درون مجموعهای سلولی داشته باشند، این کارکردها باید با یکدیگر هماهنگ میشد بعدها وقتی ماهیچهها شروع به حرکت با نیروی کششی کردند، احتمالاً برای تغذیهی خود متکی بر سلولهای چربی شدند. میتوان فهمید که دستگاهی عصبی که به هر دو بافت پیام میدهد میتوانسته ارتباط شیمیایی را زاید و غیرضروری کند اما اکنون میدانیم که پیوند هورمونی ــ و سرشت مستقل بافتهای پیرامونی ــ هیچگاه ازبین نرفته است. وقتی گروههایی از سلولهای تخصصیافته به وجود آمدند، کل موجود زنده از اطلاعات دریافتشده از تکتک بافتها برای تنظیم و تعدیل اندامهای دیگر بهره برد. همانطور که کرسنتی میگوید، «هیچ یک از اندامهای بدن ما یک جزیره نیست.»
به گفتهی کرسنتی، اتفاق مهم زمانی رخ داد که مهرهداران از آب به سوی خشکی رفتند. هنگامی که استخوانماهی (bony fish) خانهی آبی خود را حدود 360 تا 390 میلیون سال پیش ترک کرد، اسکلت مجبور شد به ساختار بسیار اساسیتری تبدیل شود تا امکان حرکت روی خشکی را فراهم کند ــ نیروی بالابرِ آب دیگر وجود نداشت، و باید به وسیلهی استخوانهای محکم در مقابل نیروی جاذبه مقاومت میشد. این استخوانهای فزاینده به انرژی هر چه بیشتری نیاز داشتند. و حیوانات زمین دیگر آزاد نبودند که کلسیم و فسفر را با محیط آبیِشان مبادله کنند. در عوض، این مواد معدنی باید مصرف، ذخیره و تنظیم میشد. استخوان کمک کرد تا این مشکل حل شود، به این ترتیب که منبعی پویا برای ذخیرهی کلسیم و آزاد کردن آن شد.
داگلاس دی گیرولامو همکارِ گاه و بیگاه کرسنتی نوشته است که این کارکردهای استخوان که به طرز شگرفی بسط و گسترش پیدا کردهاند نمیتوانستند در خلأ به وجود آیند بلکه یک اسکلت مرکب از مواد معدنی باید خود را با واکنش نشان دادن به هورمونها و با آزاد کردن آنها به صورت حلقههای درونریز موجود شکل میداد و یکپارچه میکرد. به این طریق، استخوان سبب شد که حلقهها لایههای بیشتری یابند و پیچیدهتر شوند، و این گونه راه و جای جدیدی برای خود در فیزیولوژی حیوان دست و پا کرد.
اندام دیگری که، نه در دورهی تکوین و تحولش بلکه بارها و بارها در طی دوران بارداری حیوان پستاندار، چنین میکند جفت است. هنگامی که جفت به جریان خون مادر دسترسی پیدا کرد هورمونهای بسیاری را ترشح میکند که فیزیولوژی مادر را بازسازی میکند تا نیازهای جنین را رفع کند. مادر و جنین را میتوان شبکهای واحد از تعاملات هورمونی دانست، و نه دو شبکهی جداگانه که مجاور یکدیگرند.
اینکه جفت شامل ژنهای پدرِ جنین است میتواند سبب شود که در صدد بهرهبرداری از فیزیولوژی مادر به نفع جنین باشد. اما این نوع بهرهبرداری در سامانهی دیگری که پریمون به تفصیل آن را مطالعه میکند سرشت مبهم و نامعلومتری دارد: نوعی تومور روده، که در پشهی میوه معمول است، و به نظر میرسد که مجموعهای از هورمونها را به کار میگیرد تا بدن را به سوی شرایطی سوق دهد که تومور برای رشد نیاز دارد. سلولهای سرطانی شکر آزاد میکنند که سبب میشود بافتهای دیگر تحلیل بروند تا تومور بتواند خود را تغذیه کند. پریمون امیدوار است که این الگویی باشد که چشماندازهای تازه و سودمندی در مورد فرایند تحلیل رفتن ماهیچه در بیماران سرطانی ارائه کند.
این نوع از بینشها میتواند به درمانهای پیشرفته و توجه به سرطان و بیماری شبکهی ارتباطی میاناندامی بینجامد. به گفتهی کرسنتی، «با بررسیِ هر یک از اندامها ممکن است از تعاملات میان اندامها که از حیث کارکردی بینهایت مهماند غافل شویم. و اگر آنها از حیث کارکردی بینهایت مهماند، پس در واقع و عملاً از حیث پزشکی بینهایت مهماند. لازم است که مرزهای میان این انبارها را، اندام به اندام، بشکافیم.»
اما در سطح دانشگاهی، پیچیدگی محض شبکهی ارتباطی میاناندامی پریمون را اذیت میکند. به گفتهی او، آنچه در حال حاضر از همه بغرنجتر است این است که هورمونهای خاصی هستند که بر طبق شرایطی که آزاد میشوند، و بر طبق آنکه کدام بافت آنها را آزاد میکند اثرات متفاوت، و حتی متضادی، دارند. برای مثال، اگر عامل الف توسط ماهیچه آزاد شود ممکن است اثری بر مغز داشته باشد که متفاوت با وقتی باشد که چربی آن عامل را ترشح میکند. شاید علت این باشد که عامل الف به همراه عوامل دیگری، که وابسته به شرایط است، به مغز میرسد، و اینها با هم تعیین میکنند که مغز چگونه پاسخ دهد. یا شاید مغز پیش از آن که چربی عامل الف را آزاد کند در وضعیتی باشد که متفاوت با وقتی است که ماهیچه آن عامل را آزاد میکند. مسئلهی بغرنج این است که مولکولهای پیامدهنده از آنجا میآیند، خواه از سلولهای چربی، ماهیچه، روده یا سلولهای ایمنی بیایند.
اگر شبکهی ارتباطی میاناندامی، یا دستگاه غدد درونریز، مجموعهی آموزندهای از فرامین باشد باید منطق شیمیایی درونیاش را تعیین کرد. برخلاف دستگاه عصبی ــ که در آن عصبها با سلولهایی که بر آنها تأثیر میگذارند تماس فیزیکی دارند ــ در مورد دستگاه غدد درونریز وضوح یا برجستگیِ کالبدشناختی وجود ندارد. سلولها صرفاً مولکولهایی را به درون سیال گردشکنندهی در حال گذر تراوش میکنند، و این مولکولها مسافت زیادی را میپیمایند تا با هر چیز ممکنی مواجه شوند. در هر لحظهی معین فقط حجمی از خون وجود دارد که وضعیت تمام بافتهای مختلف و پراکندهی بدن را نشان میدهد. با توجه به پیچیدگی حیرتانگیز آن، پریمون از این موضوع نگران است که آزمایشهای جاری معمولاً فقط متغیرهای اندکی را دنبال میکنند ــ مثل هورمون مورد علاقه و یک یا دو پیامد مورد علاقه. اگر چند سامانه در حال تعامل باشند، این چند سامانه نیاز به نظارت و کنترل دارند.
او با توجه به آنچه تا کنون به دست آمده میگوید: «تحقیقات دقیقاند، آنها چیزهایی میگویند دربارهی آن چه این عوامل انجام میدهند اما ما فقط داریم یک تکهی کوچک از پازل را به دست میآوریم. و آنچه اکنون نمیفهمیم، پیچیدگیِ این پازل است.»
برگردان: افسانه دادگر
لیام درو نویسنده، بنیانگذار و مدیر گروه «نورایت» در لندن است که امکان گفتوگو میان دانشمندان و نویسندگان را فراهم میکند. آنچه خواندید برگردان این نوشتهی او با عنوان اصلیِ زیر است:
Liam Drew. ‘Hormones United’, Aeon, 19 February 2019.

